同济大学第一附属中学2019学年第一学期期中
化学考试(满分100分;考试时间60分钟)
相对原子水平:H-1 C-12 O-16
选择题(本题共40分,每小题2分,每题只有一个正确选项)
1.下列对化学科学的认知错误的是
A.化学是一门以实验为基础的自然科学
B.化学家可以制造源于然界中没有的物质
C.物质发生化学反应都随着着能量变化
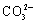 D.化学研究会导致紧急的环境污染,人类终将毁灭在化学物质中
D.化学研究会导致紧急的环境污染,人类终将毁灭在化学物质中
2. 垃圾分类有益于资源收购借助下列垃圾归类不适当的是
![]() 3.下列有关化学用语表示正确的是
3.下列有关化学用语表示正确的是
A.N2的电子式:
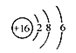
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
131 53I
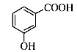
D.邻羟基苯甲酸的结构简式:
4.关于石油的说法正确的是
![]() A.石油是可再生矿物能源 B.石油主要含有碳、氢两种元素
A.石油是可再生矿物能源 B.石油主要含有碳、氢两种元素
![]() C.石油裂化是物理变化 D.石油分馏是化学变化
C.石油裂化是物理变化 D.石油分馏是化学变化
 5.右图是一种有机物的模型,该模型代表的有机物可能是
5.右图是一种有机物的模型,该模型代表的有机物可能是
A.饱和一元醇 B.羟基酸
C.羧酸酯 D.饱和一元醛
6.有关NaCl晶体的性质,正确的是
A.易导热 B.易熔化 C.熔融状况能导电 D.有延展性
7.水的离子积常数随温度升高而升高。关于适量的水,下列叙述正确的是
A.温度升高,水中分子总数降低 B.水中c随温度升高而减少
C.水的pH随温度升高而升高 D.水的电离过程是放热过程
8.向CH3COOH溶液逐滴加入NaHCO3溶液反应的离子方程式正确的是
![]()
![]()
![]() A.
A.![]() + → H2O + CO2↑ B.2CH3COOH + → H2O + CO2↑ +
+ → H2O + CO2↑ B.2CH3COOH + → H2O + CO2↑ +
![]()
![]()
![]() C.
C.![]() + → H2O + CO2↑ D.CH3COOH + → H2O + CO2↑ +
+ → H2O + CO2↑ D.CH3COOH + → H2O + CO2↑ +
9.下列离子在稳定人体血液的pH中起用途的是
A. Na+ B. HCO3- C. Fe2+ D. Cl-
seline;"=""> 10.2-氯丁烷常用于有机合成等,有关2-氯丁烷的叙述正确的是
seline;"="">A.它的同分异构体除本身外还有4种
seline;"="">B.与硝酸银溶液混合产生不溶于稀硝酸的白色沉淀
seline;"="">C.微溶于水,可混溶于乙醇、乙醚、氯仿等多数有机溶剂
seline;"="">D.与氢氧化钠、乙醇在加热条件下的消去反应有机产物只有一种
11.肯定温度下,恒容密闭容器中发生N2+3H2![]() 2NH3反应,反应速率与反应时间的关系如图所示。对两种平衡状况下各物理量的比较错误的是
2NH3反应,反应速率与反应时间的关系如图所示。对两种平衡状况下各物理量的比较错误的是
seline;"="">  A.平衡状况Ⅱ时的c 肯定小
A.平衡状况Ⅱ时的c 肯定小
seline;"="">B.平衡常数K一样大
seline;"="">C.平衡状况Ⅱ时的c 肯定大
seline;"="">D.平衡状况Ⅱ时的v 肯定大
12.关于氯化铵溶液,下列有关说法正确的是
A.溶液中c = c
B.加水稀释后溶液酸性增强
C.可除去某些金属表面的氧化物
D.微热促进水解平衡右移氯离子数目增多
13.元素的原子结构决定其性质和在周期表中的地方。下列说法正确的是
A.元素原子的最外层电子数等于元素的最高化合价
B.多电子原子中,在离核较近的地区内运动的电子能量较高
C.P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
D.元素周期表中坐落于金属和非金属分界线附近的元素是过渡元素
14、室温下向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减小
B.溶液中的![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液pH=7
seline;"="">
seline;"=""> 15.为探究雾霾颗粒中的可溶性成分,某课外活动小组采集雾霾颗粒样品,用蒸馏水浸获得到浸取液,取浸取液进行以下实验,其中依据实验现象得出的结论正确的是
A.滴入NaOH溶液,有白色沉淀产生,说明雾霾中肯定含Mg2+
B.滴入AgNO3溶液,有白色沉淀产生,说明雾霾中肯定含Cl―
C.滴入硝酸酸化的BaCl2溶液,有白色沉淀产生,说明雾霾中肯定含SO42―
D.加入浓NaOH溶液微热,试管口的湿润红色石蕊试纸变蓝,说明雾霾中肯定含NH4+
seline;"="">
seline;"=""> 16.已知还原性 I— > Fe2+ > Br—,在只含有I—、Fe2+、Br—的溶液中通入适量的氯气,所得溶液中可能存在的离子是
seline;"=""> A.I—、Fe3+ B.Fe2+、Br— C.Fe2+、Fe3+ D.Fe2+、I—
17.下列制取SO2、验证其漂白性、采集并进行尾气处置的装置和原理能达到实验目的的是

A.制取SO2 B.验证漂白性 C.采集SO2 D.尾气处置
18.常温下,amol·L-1的稀氨水和bmol·L-1的稀盐酸等体积混合,下列判断肯定正确的是
A.若a=b,则c)=c B.若a>b,则c)>c
C.若a>b,则c>c D.若a
19.下列试验中,所选装置不适当的是

离别Na2CO3溶液和CH3COOC2H5,选④
用CC14提取碘水中的碘,选③
用FeC12溶液吸收C12选⑤
粗盐提纯,选①和②
20.H2O2分解速率受多种原因影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是

A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
2、综合剖析题(共60分)
(一)(本题共15分)
“容易见到无机物”,主如果指的铝、铁、硫、氯四种元素的单质及化合物。完成下列填空:
21、四种元素原子的半径大小Fe >______>______>______。
22、铝原子核外电子排布式______________________________,有_________种不同能量的电子。
23、若铝热剂的成分是铝粉与氧化铁的混合物,写出该铝热反应的化学方程式____________________,并标明该反应的电子转移方向和数目。
24、工业上用氯气和__________制获得到漂粉精,其有效成分是_____________(写化学式)。
25.硫的非金属性________于氯,请用一个事实证明______________________,
再从原子结构的角度加以讲解____________________________________________________。
seline;"="">  (二)(本题共15分)
(二)(本题共15分)
可用以下办法处置尾气中的SO2。
办法1、活性炭还原法:
反应原理:恒温恒容2C +2SO2![]() S2+2CO2+Q
S2+2CO2+Q
反应进行到不同时间测得各物质的浓度如图:
26.首次达到平衡的时间是第______________________________min;0~20min化学反应速率表示v=__________
27.30min时平衡发生移动的条件是__________
28.40min时,平衡常数的计算式为__________。 (指代入具体数值的算式)
办法2、亚硫酸钠吸收法
 29.Na2SO3溶液吸收SO2的离子方程式为__________ ;
29.Na2SO3溶液吸收SO2的离子方程式为__________ ;
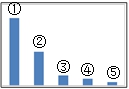
seline;"=""> 30.右图是Na2SO3溶液中各离子浓度的相对大小关系示意图。
seline;"=""> 其中③是________。(填微粒符号)
常温下,当吸收至pH=6时,吸收液中有关离子浓度关系肯定正确的是____(填序号)
a.c(Na+)+c(H+) > c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-) + c(HSO3-)+ C(H2SO3)
c. 水电离出c(OH一)=l×l0-8 mol/L,
(三)(本题共16分)
聚合物F的合成路线图如图:
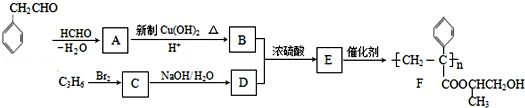
已知:HCHO+RCH2CHO→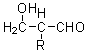
![]()
![]()
请据此回答:
31.A中含氧官能团名字是__________,C的系统命名为__________。
32.检验B中所含官能团所用的试剂为__________、__________;E→F的反应种类是__________,B+D→E的反应种类是__________。
33.写出A→B的化学方程式为__________。
34.写出C→D的化学方程式为__________。
35.参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要材料制备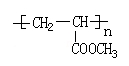 的合成路线
的合成路线
(四)(本题共14分)
氮的氧化物是大方污染物之一,工业上在肯定温度和催化剂条件下用NH3将NOx还原生成N2,某同学在实验室中对NH3与NOx反应进行了探究。回答下列问题:
36.氨气的制备
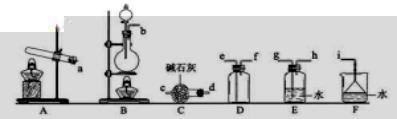
①氨气的发生装置可以选择上图中的_________,反应的化学方程式为_______________。
②预采集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→______。
37.氨气与二氧化氮的反应
将上述采集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2。在肯定温度下按图示装置进行实验。

操作步骤 | 实验现象 | 讲解缘由 |
打开K1,推进注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |







