![]() 《常见的金属和盐》测试
《常见的金属和盐》测试
1、单选题(每小题只有一个正确答案)
1.物质性质决定作用与功效。下列说法不正确的是
A.氧气具备助燃性,可用于炼钢
B.氩气的化学性质稳定,可用作焊接金属的保护气
C.铜的导电性最强,可用于家用电线
D.食醋具备酸性,可用于除去水壶中的水垢
2.在日常涉及到很多变化,下列变化中不包括化学变化的是( )
A.用煤气作燃料烧饭做菜 B.石蜡受热融化
C.铁制品生锈 D.用石灰浆涂抹墙壁后,表面有水珠生成
3.已知化学反应2NO+O2=2NO2,该反应是
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
4.久置的石灰水试剂瓶的内壁有一层白膜,要除去白膜最好使
A.氯化钠溶液 B.苛性钠溶液 C.稀盐酸 D.硫酸钠
5.如图中“﹣”表示相连的两种物质能发生反应,“→”表示一种物质转化成另一种物质,部分反应物、生成物及反应条件未标出。则不可能出现的状况是()

A.甲是C、乙是CO2 B.乙是CO,丙是CO2
C.甲是HNO3,丙是NaNO3 D.乙是Cu(OH)2、丙是CuSO4
6.下列实验不可以达到相应目的的是()
A探究温度对固体溶解速率的影响 | B探究铁生锈的条件 | C探究分子运动 | D探究二氧化锰的催化用途 |
|
|
|
|
A.A B.B C.C D.D
7.有关金属资源的叙述错误的是()
A.地球上金属资源大部分以化合物形式存在
B.现在世界年产量最高的金属是铁
C.铁锈的主要成分是四氧化三铁
D.准时擦干被雨水淋湿的自行车可预防自行车生锈
8.将铝粉和氧化铜混合加热,反应的化学方程式为3CuO+2Al![]() 3Cu+Al2O3.充分反应后,为了检验氧化铜是不是剩余,取少量反应后的固体,加入足量稀硫酸,充分反应,可以说明氧化铜有剩余的实验现象是()
3Cu+Al2O3.充分反应后,为了检验氧化铜是不是剩余,取少量反应后的固体,加入足量稀硫酸,充分反应,可以说明氧化铜有剩余的实验现象是()
①加入稀硫酸后,有气泡产生
②加入稀硫酸后,溶液显蓝色
③加入稀硫酸后,没气泡产生
④加入稀硫酸后,容器中有红色不溶物质
⑤在加稀硫酸后的溶液中,插入铁片,铁片表面有红色不溶物质析出。
A.只有① B.只有② C.③④ D.②⑤
9.下列实验策略能达到实验目的是
选项 | 实验目的 | 实验策略 |
A | 辨别Na2SO4溶液和AgNO3溶液 | 分别加入BaCl2溶液 |
B | 检验NaOH溶液是不是变质 | 取样品加无色酚酞试液,察看溶液颜色是不是变红 |
C | 除去氢气中的氯化氢气体 | 先通过氢氧化钠溶液,再通过浓硫酸 |
D | 除去氯化钠溶液中的碳酸钠 | 加入稀硫酸不再产生气泡 |
A.A B.B C.C D.D
10.逻辑推理是化学学习中常见的思维办法.下列推理正确的是()
A.中和反应生成盐和水,则生成盐和水的反应肯定是中和反应
B.活泼金属能与稀硫酸反应放出气体,则与稀硫酸反应放出气体物质肯定是活泼金属
C.单质中只含有一种元素,所以只含有一种元素的物质肯定是单质
D.化合物是由不同种元素组成的纯净物,所以由不同种元素组成的纯净物肯定是化合物
11.下列有关物质的性质和作用与功效没对应关系的是
选项 | 性质 | 作用与功效 |
A | 氧气支持呼吸 | 呼吸面罩 |
B | 金刚石硬度大 | 切割玻璃 |
C | 碳酸氢铵不稳定 | 化肥 |
D | 干冰升华吸热 | 人工降雨 |
A.A B.B C.C D.D
12.除去下列各组物质中的杂质(括号内杂质),所使用的试剂及操作办法均正确的是()
选项 | 物质 | 使用试剂 | 操作办法 |
A | Fe2O3(Fe) | 盐酸 | 浸泡、过滤、洗涤、烘干 |
B | CuO (Cu) | 空气 | 充分灼烧 |
C | CaO(CaCO3) | 水 | 溶解、过滤、烘干 |
D | NaCl(Na2CO3) | Ca(NO3)2溶液 | 溶解、过滤、蒸发结晶 |
A.A B.B C.C D.D
13.不需要其他试剂辨别下列五种物质的溶液①H2SO4;②FeCl3;③Ba2;④KCl; ⑤BaCl2.被辨别出的物质的顺序是
A.②①③⑤④ B.②③①⑤④ C.⑤①③②④ D.③②①④⑤
14.下列各组物质在水中能很多共存的是()
A.硫酸、硫酸钠、氢氧化钠 B.氢氧化钙、氯化钠、碳酸钾
C.氯化钠、氢氧化钠、碳酸钠 D.硫酸铜、氢氧化钠、铁
15.在适量AgNO3和Cu2的混合溶液中加入铁粉,充分反应,下列有关变化曲线,肯定不正确的是
A. B.
B.
C. D.
D.
2、填空题
16.无土栽培是借助营养液栽培作物的一种办法。

下列化学肥料中是复合肥的是_____;
①硝酸铵②磷酸二氢铵③硝酸钾④硫酸钾
某同学要在实验室配制150g溶质水平分数为2%的硝酸钾溶液,需要硝酸钾的水平为__g。
17.日常处处有化学。请回答下列问题:
下列净水办法中净化程度最高的是__________。
A.煮沸 B.吸附 C.蒸馏 D.消毒
煤、石油、天然气现在在世界能源结构中占主体地位,它们都是__________
预防铁质菜刀生锈的办法是______________________________。
炒菜时油锅里的油失火,可用锅盖盖灭,所借助的灭火原理是________________。
稀土元素铕是激光及原子能应用的要紧材料。已知氧化铕的化学式为Eu2O3,则三氯化铕的化学式为______________。
18.填写下列金属的元素符号:
应用最广泛的金属是________ ;用于包装糖果、烟的银白色金属材料是________ ; 温度计中的金属是______ ;导电性仅次于银,常用于做导线的是_______ .
19.日常处处有化学。请将下列事例体现的化学原理的序号写在横线上。
生产冰淇淋时加入某些物质使材料中的油脂以小液滴的形式均匀分散在水中。_______
修理汽车工人用汽油清洗手上的油污。_________
夏季放在仓库里的化肥—碳酸氢铵变少了。______
生煤炉的过程:引燃废纸或干草再加入小木片或小木块,最后加入蜂窝煤。____________
20.氧化还原反应是自然界中一个尤为重要的反应种类,对大家的生产、生活有着十分要紧有哪些用途。一般地说,但凡化学反应前后元素化合价有变化的反应肯定是氧化还原反应,而且在一个氧化还原反应中,元素化合价升高的反应为氧化反应,化合价减少的反应为还原反应,氧化反应和还原反应同时发生,大家可以把初中阶段学过的四种基本种类的反应和氧化还原反应的关系总结如右图:其 中Ⅰ为化合反应,则Ⅱ为______反应。写出一个有水生成的符合反应种类Ⅲ的化学方程式:__________________________________________ 。化学反应C+H2O=CO↑ + H2↑,是图中的反应________,其中水作为___________________剂。

3、判断题
21.A、B、C、D、E、F都是初中化学中容易见到的物质,它们之间的相互转化关系如下:
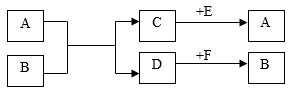
若A、C组成元素相同,D为红色固体单质,写出A和B反应的化学方程式____。
若A、C组成元素相同,B中两种元素的水平比为21:8,D为能被磁铁吸引的黑色粉末,则:①E的化学式是____;F的化学式是 ____;
②A和B反应的化学方程式是____.
22.某小组同学用二氧化碳、一氧化碳、氧气、氢气、水、铁这六种物质,以CO2为起点进行了击鼓传花游戏,条件是相互之间能达成一步转化时花束就能进行传递,使花束能从起点CO2传到E,已知地方A的物质具备毒性,请把上述除CO2以外的其余物质分别安排在A~E的地方上,并回答下列问题:

⑴写出地方A的物质的化学式_____。
⑵写出如图转化中是置换反应的化学方程式_____。
⑶E可以在肯定条件一步转化为CO2又回到起点,请写出另一种坐落于地方E也符合如图转化并能一步转化为CO2又回到起点的物质_____(填化学式)。
⑷a、b、c、d四步转化中也可逆向转化的是_____(从a、b、c、d中选填)。
4、实验题
23.某化学兴趣小组完成了下列两个实验:
实验1:用试管取适量NaOH溶液,并滴加2滴酚酞溶液,再加入稀盐酸,红色恰好消失。
实验2:用试管取适量澄清的石灰水,然后加入饱和的Na2CO3溶液。
实验结束后,把两支试管里的物质倒入同一烧杯,静置,烧杯中有白色沉淀,上层澄清液显红色。
同学们欲对该澄清液成份进行探究,请你参与,完成下列问题:
(问题剖析)
(1)实验1的目的是验证__________(填化学原理);
(2)实验2中产生白色沉淀的化学方程式__________;
(3)澄清液显红色,说明该澄清液显碱性,其中溶质除肯定有NaOH外,还可能含有__________或__________。
(实验验证)
①取澄清液,加入适当的CaCl2溶液,没有明显现象,则澄清液中不含__________;
②取澄清液,通入CO2气体,产生浑浊,写出产生浑浊的化学方程式__________。
(交流深思)化学反应后形成的溶液中溶质的确定,既要考虑反应产物,也要考虑反应物是不是过量。
24.人类社会的进步不能离开金属。
(1)钢铁锈蚀主如果铁与空气中的__________等物质发生化学反应的结果。
(2)地铁施工中挖掘岩石的刀片用钨钢制成,据此推断钨钢具备的一条物理性质:_________。
(3)向肯定水平AgNO3和Cu2的混合溶液中加入适量锌粉,充分反应后过滤,得到滤渣和滤液。
①向洗净后的滤渣中滴加稀盐酸产生气泡,该气体是_______。
②若滤液呈蓝色,则滤液中或许会有些溶质是_______(填化学式)。
5、计算题
25.“黄铜”是铜锌合金,可塑性好,耐腐蚀,很多“金色”饰品就是用它来制作的。现称取20.0g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至没气泡产生为止,请结合下列图示计算。

该20.0g黄铜样品中含锌的水平为____g。
完全反应时生成硫酸锌的水平是______克。
26.硝酸银有收敛、腐蚀和杀灭细菌有哪些用途,对淋球菌特别敏锐,临床上常用含低浓度硝酸银的眼药水为新生儿预防眼炎。向17g某含硝酸银的眼药水中加入含0.0585g氯化钠的溶液,恰好完全反应,请计算该眼药水中硝酸银的水平分数。(假设眼药水中其他成分不与氯化钠发生反应)
参考答案
1.C 2.B 3.A 4.C 5.C 6.D 7.C 8.D 9.C 10.D 11.C 12.B 13.B 14.C 15.B 16. ②③ 3
17. D 混合物 洗净晾干 隔绝了空气 EuCl3
18.Fe Al Hg Cu
19.B C E F
20. 分解反应 NaOH + HCl = H2O + NaCl Ⅳ 氧化
21.CuO+CO![]() Cu+CO2 C O2 4CO+Fe3O4
Cu+CO2 C O2 4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
22.CO Fe+H2SO4=FeSO4+H2↑ H2CO3 acd
23.【问题剖析】
(1)NaOH+HCl=NaCl+H2O
(2)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
(3)碳酸钠 氢氧化钙
【实验验证】
①碳酸钠
②CO2+Ca(OH)2=CaCO3↓+H2O
24.氧气、水 硬度大 H2 AgNO3
25.6.5 16.1
26.1%