 上海玉华中学初三(上)首次月考化学试题
上海玉华中学初三(上)首次月考化学试题
1、选择题:(答案填在下方表格中,每题1分,共计20分)
1.(1分)下列物质的性质是水的化学性质的是()
A.水具备非常不错的分散性
B.1 标准大方压下,水的沸点为 100℃
C.水通电能分解
D.4℃时,水的密度最大
2.(1分)下列物质是纯净物的是()
A.雨水 B.石灰水 C.冰水 D.自来水
3.(1分)下列物质中,是溶液的是()
A.豆腐花 B.牛奶 C.米粥 D.雪碧
4.(1分)温度升高时溶解度反而减小的是()
A.氯化钠 B.硝酸钾 C.蔗糖 D.二氧化碳
5.(1分)室温时,对100mL氯化钠饱和溶液作如下操作,最后甲、乙两烧杯中溶液()

A.溶质水平相同 B.溶质水平分数相同
C.均为不饱和溶液 D.溶剂水平相同
6.(1分)50℃时,氯化铵的溶解度是50g,50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的水平比为()
A.1:2:3 B.2:3:
1 C.3:2:
1 D.1:3:2
7.(1分)要使 50℃时不饱和的硝酸钾溶液变成饱和溶液,下列手段中错误的是()
A.升高温度 B.减少温度 C.补充硝酸钾 D.蒸发水分
8.(1分)t℃时,某物质的溶解度为 S 克/100 克水,其饱和溶液的水平分数为 C%,则 S 与C 的数值关系为()
A.S>C B.S=C C.S<C D.没办法判断
9.(1分)某温度时,在m g食盐溶液中加入n g食盐,经充分搅拌后,得w g食盐溶液。则m、n、w之间的关系为()
A.m+n=w B.m+n≤w C.m+n≥w D.m+n<w
10.(1分)影响固体物质在溶剂中溶解度大小的原因有()
①固体物质的性质,②温度,③压强,④溶质的水平,⑤溶剂的水平,⑥溶剂的性质.
A.①②⑥ B.①③⑤ C.①④⑤ D.②④⑥
11.(1分)固体物质溶解度曲线上的任意一点表示()
A.肯定温度和适量溶剂里溶解溶质的水平
B.相应温度下,100克溶剂里溶解溶质的水平
C.相应温度下,100克溶剂里最多能溶解溶质的水平
D.溶液达到饱和状况时溶解溶质的水平
12.(1分)20℃时,20 克水中溶解了 4 克氯化铵,则 20℃时,氯化铵的溶解度是()
A.4 克/100 克水 B.20 克/100 克水
C.24 克/100 克水 D.没办法计算
13.(1分)20℃时,100 克 A 物质的溶液,首次蒸发 10 克水,析出 1 克晶体,第二次蒸发 10 克水,析出 2 克晶体,则该温度下,物质 A 的溶解度为()
A.15 克/100 克水 B.10 克/100 克水
C.20 克/100 克水 D.没办法确定
14.(1分)对 100 克溶质水平分数为 10%的某物质的溶液,分别进行如下操作:①加入 10g 水 ②加入 10g 同种溶质,且完全溶解 ③加入溶质水平分数为 10%的同种溶质的溶液 10g ④蒸 发掉 10g 水,无晶体析出。操作后的四种溶液中溶质的水平分数由小到大的顺序是()
A.①②③④ B.①③④② C.④③②① D.④②③①
15.(1分)打开汽水瓶盖有很多气体逸出,下列说法中错误的是()
A.溶质减小 B.溶解度减小
C.变成不饱和溶液 D.压强减小
16.(1分)20℃时,在 100 克食盐溶液中,加入 5 克食盐,加入食盐后的溶液中,水平肯定不发生变化的是()
A.溶剂的水平 B.溶质的水平
C.溶液的水平 D.溶质、溶剂、溶液的水平
17.(1分)在温度不变的条件下将Ag白色硫酸铜粉末放入肯定水平的饱和硫酸铜溶液中,得到Bg蓝色晶体,下列叙述正确的一组是()
①溶液的浓度不变 ②A、B的水平关系是B>A ③溶液中溶剂的水平降低 ④溶液成为不饱和溶液
A.①② B.②③④ C.①③④ D.①②③
18.(1分)20℃时,100g 水中不断加入 NaCl 固体,充分搅拌后过滤,称量所得溶液的水平如表 所示,其中是饱和溶液的是()
选项 | ① | ② | ③ | ④ |
加入 NaCl 水平(g) | 5 | 15 | 36 | 40 |
所得溶液水平(g) | 105 | 115 | 136 | 136 |
A.①② B.②③ C.③④ D.都是
19.(1分)若分别将 100g 甲、乙的饱和溶液从 t2℃降温到 t1℃,对所得溶液的叙述正确的是()

A.甲、乙都是饱和溶液 B.溶质水平分数:甲=乙
C.溶液水平:甲>乙 D.所含溶剂水平:甲<乙
20.(1分)70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出,然后冷却至30℃并维持温度不变。能正确表示此过程中溶质水平分数(x%)与时间(t)的关系的示意图是()
A. B.
B.
C. D.
D.
2、填空题(22分)
21.(4分)依据需要填写下列物质的化学式:
(1)生理盐水中的溶质是__________,(2)从饱和硫酸铜溶液中析出的蓝色晶体__________;
(3)硝酸银溶液中的溶质是__________,(4)37%的浓盐酸中的溶质__________。
22.(6分)将生石灰投入盛有水的烧杯中,充分搅拌,形成的是__________.(悬浊液、乳浊液、溶液).将该液体静置一会儿,取上层清液,该清液是__________(悬浊液、乳浊液、溶液).组成该清液的物质为__________和__________,其中前者属__________(溶质或溶剂,下同),后者属__________.
23.(4分)向 20℃的饱和石灰水中加入少量氧化钙(CaO)粉末,至充分反应。请结合题目回答:
(1)加入氧化钙粉末后,溶液的温度将__________(升高、减少或不变);发生的化学反应方程式为__________;
(2)反应后溶液的水平跟原石灰水相比将会__________(增加、降低或不变)。
(3)恢复至 20℃,所得溶液的水平分数和原石灰水相比将会__________(增加、降低或不变)。
24.(8分)叶脉书签既别致又实用,颇受同学们的喜欢。小芳和小丽欲配制 200 克 10%的氢氧化钠溶液为同学们制作一些叶脉书签。
(1)小芳用固体氢氧化钠和水配制,操作步骤为__________、__________、__________。
由于氢氧化钠有腐蚀性,称量时需要放在__________中。
(2)小芳通过计算求得需氢氧化钠固体__________克,水__________毫升。
(3)小丽则想用 20%的氢氧化钠溶液和水来配制 200 克 10%的氢氧化钠溶液。请帮她计算需要 20%的氢氧化钠溶液__________克?水__________毫升?
3、简答卷(18分)
25.(2分)现有30%的硝酸钠溶液200g,加热蒸发90g水,冷却至原温度,有20g硝酸钠晶体析出.则蒸发后溶液的水平为__________g,该温度下,硝酸钠的溶解度为__________g(g/100g水).
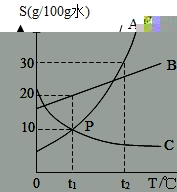
26.(6分)如图为A、B、C三种物质的溶解度曲线,请回答:
(1)P点表示的意思是__________。
(2)t3℃时,A、B、C三者溶解度的大小关系为__________。
(3)将t1℃时B的饱和溶液升温至t3℃,此时溶液的水平__________(填“增大”、“减小”或“不变”)。
(4)t2℃时,将30克B溶解到60克水中,得到的溶液为__________(填“饱和溶液”或“不饱和溶液”),溶质水平分数为__________。
(5)从C的饱和溶液中获得C晶体的最好办法为__________。
27.(4分)如表是甲、乙、丙三种物质的部分溶解度(单位:g/100g水),请回答。
温度(℃) | 10 | 20 | 30 | 40 | 50 | 60 |
甲 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
乙 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
丙 | 0.182 | 0.165 | 0.160 | 0.141 | x | 0.121 |
①10℃时,甲物质的溶解度是__________g/100g水;
②三种物质中溶解度受温度影响较大的是__________;
③物质在水中的溶解性与其溶解度(20℃)的关系示意图如图1,则丙物质在水中的溶解性是__________;
④30℃时,乙物质饱和溶液的溶质水平分数是__________;(列式即可,不需要计算)
⑤50℃时,三种物质的溶解度由大到小的顺序是__________;
⑥向不同温度的100g水中分别放入等水平的乙物质,维持温度不变,溶解状况如图2所示。有关剖析正确的是__________;
a.溶液温度:Ⅰ>Ⅱ>Ⅲ>Ⅳ
b.溶液水平:Ⅰ=Ⅱ>Ⅲ>Ⅳ
c.溶液Ⅰ肯定是不饱和溶液
d.使Ⅳ中的固体全部溶解,溶质水平分数可能不变。
28.(6分)A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示.
(1)t1℃时,将15gA加入到__________g水中,完全溶解后,恰好得到饱和溶液;为了进一步提升该溶液的溶质水平分数,可进行的操作是__________;
(2)若将t2℃时三种物质的饱和溶液分别降温到t1℃,降温后溶质水平分数最小的是__________物质的溶液(填“A”、“B”或“C”);
(3)对于溶解度曲线上的一点P,以下描述中肯定正确的是__________(填序号);
a.A和C的溶液溶质水平分数相同 b.C的溶液100g中有10g溶质
c.B的溶液处于不饱和状况 d.A、C的溶液水平相同
(4)取A、B的混合物50g溶于100g热水,待冷却到t1℃,若A析出而B不析出晶体,则混合物中A的水平分数w的取值范围是__________.
2018-2019学年上海玉华中学初三(上)首次月考化学试题
参考答案与考试试题分析
1、选择题:(答案填在下方表格中,每题1分,共计20分)
1.【解答】解:A、水具备非常不错的分散性,无需通过化学变化表现出来,是物理性质;
B、1标准大方压下,水的沸点为100℃,无需通过化学变化表现出来,是物理性质;
C、电解水可以生成氢气和氧气,需要通过化学变化表现出来,是化学性质;
D、4℃时,水的密度最大,无需通过化学变化表现出来,是物理性质。
故选:C。
2.【解答】解:A、雨水中有可溶性杂质和不溶性杂质,是混合物;故选项错误;
B、石灰水中有氢氧化钙和水,是混合物;故选项错误;
C、冰水中只有水分子,是纯净物,故选项正确;
D、自来水中有可溶性杂质、消毒剂等,是混合物;故选项错误;
故选:C。
3.【解答】解:A、豆腐花不均一不稳定,不是溶液,故A错;
B、牛奶是乳浊液,不均一不稳定,故B错;
C、米粥不均一不稳定,是悬浊液,故C错;
D、雪碧是均一稳定的混合物,是溶液,故D正确。
故选:D。
4.【解答】解:A、NaCl的溶解度受温度的影响变化不大,故选项错误。
B、硝酸钾的溶解度伴随温度的升高而增大,当温度升高时,溶解度增大,故选项错误。
C、蔗糖的溶解度伴随温度的升高而增大,当温度升高时,溶解度增大,故选项错误。
D、二氧化碳的溶解度随温度的升高而减小,当温度升高时,溶解度减少,故选项正确。
故选:D。
5.【解答】解:A、因为溶液有均一性,在将甲转移溶液50mL时,甲、乙溶液中溶质水平相同。故A正确;
B、由题意可知,甲、乙溶液中溶质水平相同,溶剂的水平不同,溶质水平分数不同。故B错误;
C、由题可知,甲溶液是饱和溶液,乙是不饱和溶液。故C错误;
D、由题意可知,甲、乙溶液中溶质水平相同,溶剂的水平不同,故D错误。
故选:A。
6.【解答】解:50℃时,氯化铵的溶解度是50g,其涵义是50℃时,100g水中最多溶解50g氯化铵,溶液达到饱和状况;则50℃时氯化铵的饱和溶液中溶质、溶剂、溶液之间的水平比为50g:
100g:(50g+100g)=1:2:3。
故选:A。
7.【解答】解:A、由于硝酸钾的溶解度随温度的升高而增大,所以升高温度不能,故错误。
B、由于硝酸钾的溶解度随温度的升高而增大,所以降温可以使溶液变为饱和溶液,故正确。
C、加入硝酸钾,是使用了加溶质的办法,可以使溶液变为饱和溶液,故正确。
D、蒸发水,使用了蒸发溶剂的办法,可以使溶液变为饱和溶液,故正确。
故选:A。
8.【解答】解:该温度下其饱和溶液中溶质的水平分数为:![]() ×100%=C%,即
×100%=C%,即 ![]() ,
,![]() =S,则S>C。
=S,则S>C。
察看选项,A选项正确。
故选:A。
9.【解答】解:假如ng食盐全部溶解,则w=m+n,假如部分食盐溶于水,则w<m+n,
故选:C。
10.【解答】解:①当温度相同时,固体物质不同则溶解度不同,如20℃时氯化钠的溶解度为36g,而硝酸钾的溶解度为31.6g,所以溶质类型影响固体物质的溶解度。
②大部分固体物质的溶解度随温度的升高而增大,少数物质的溶解度受温度变化影响不大,极少数物质溶解度随温度的升高而减小,即温度影响固体物质的溶解度。
③固体物质的溶解度一般不受压强的影响。
④依据溶解度的概念,某温度时100g溶剂中最多溶解的水平为该温时该物质的溶解度,可知溶解度与溶质水平无关。
⑤依据溶解度的概念,某温度时100g溶剂中最多溶解的水平为该温时该物质的溶解度,比如,20℃时100g水最多可以溶解36g氯化钠,则称20℃时氯化钠的溶解度为36g,若该温时,
200g水则最多可以溶解72g氯化钠,但溶解度不可以说是72g,仍然要换算成100g水中最多溶解的溶质水平,溶解度仍为36g,所以溶剂水平不影响固体物质的溶解度。
⑥同一物质溶剂不同溶解能力不同,比如植物油可溶解在汽油中但不可以溶解在水中。
故选:A。
11.【解答】解:固体物质溶解度曲线上的任意一点表示相应温度下,100g溶剂里最多可以溶解溶质的水平;在该温度下某物质的溶解度是多少。
故选:C。
12.【解答】解:20℃时,20 克水中溶解了 4 克氯化铵,没说是不是达到饱和,所以没办法计算。
故选:D。
13.【解答】解:设该温度下的溶解度为x,
![]() ,x=20g;
,x=20g;
故选:C。
14.【解答】解:
100g溶质水平分数为10%的某物质的溶液中溶质的水平是100gx10%=10g。
①加入10g水,溶质水平分数小于10%;
②加入10g同种溶质,使之全部溶解,溶质水平分数=![]() ×100%=18.2%;
×100%=18.2%;
③加入溶质水平分数为10%的同种溶质的溶液10g,溶质水平分数不变仍为10%;
④蒸发掉10g水且无晶体析出,是溶液变浓,溶质水平分数=![]() ×100%=11.1%
×100%=11.1%
故选:B。
15.【解答】解:A、打开汽水瓶盖有很多气体逸出,溶质水平降低,故选项说法正确。
B、汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,故选项说法正确。
C、汽水是将二氧化碳气体加压之后制成的,打开汽水瓶盖,压强变小,二氧化碳的溶解度减小,但仍为常温常压下的饱和溶液,故选项说法错误。
D、打开汽水瓶盖,压强变小,故选项说法正确。
故选:C。
16.【解答】解:A、20℃时,在100克食盐溶液中,加入5克食盐,加入食盐后的溶液中,水平肯定不发生变化的是溶剂的水平,由于水的水平在溶解前后都没变化;故选项正确;
B、溶质的水平会增大,由于原溶液不是饱和溶液;故选项错误;
C、溶液的水平=溶质的水平+溶剂的水平,因此溶液水平也会增大;故选项错误;
D、溶质水平变大、溶剂水平不变、溶液的水平变大;故选项错误;
故选:A。
17.【解答】解:在温度不变的条件下将Ag白色硫酸铜粉末放入肯定水平的饱和硫酸铜溶液中,硫酸铜粉末与水反应生成五水合硫酸铜,溶液中溶剂降低,有硫酸铜晶体析出,所得溶液仍为该温度下的饱和溶液,溶液的浓度不变,白色硫酸铜粉末的水平小于析出蓝色晶体的水平。故①②③说法正确。
故选:D。
18.【解答】解:由20℃时NaCl溶解实验的一组数据可知,20℃时100g水中最多能溶解氯化钠36g,形成饱和溶液136g,则得到的溶液是饱和溶液的是③④。
故选:C。
19.【解答】解:A、因为甲的溶解度随温度的减少而减小,因此它的饱和溶液降温后会有晶体析出,但溶液仍为饱和溶液;但乙的溶解度随温度的减少而增大,因此它的饱和溶液降温后就会变成不饱和溶液,故A错误;
B、在t1℃时,两物质的溶解度相等,即两物质的饱和溶液中溶质的水平分数相等,但乙溶液已经不再是饱和溶液,因此溶液中溶质的水平分数甲>乙,故B错误;
C、因为甲溶液伴随温度的减少会有晶体析出,因此溶液水平会减小,而乙的溶液中没晶体析出溶液水平不会发生变化,因此降温后溶液的水平甲<乙,故C错误;
D、因为在降温过程中溶剂的水平并没发生变化,因此只须比较出它们原来的溶剂的多少即可;依据两种物质的溶解度曲线可知,在t2℃时,甲的溶解度大于乙的溶解度,即饱和溶液中溶质的水平分数甲>乙,即等量的饱和溶液中溶质的水平甲>乙,则溶剂甲<乙,故D正确。
故选:D。
20.【解答】解:70℃时的m g硝酸钾的不饱和溶液,在恒温下蒸发水分至有较多的晶体析出这一过程中,溶质的水平分数不断变大当达到饱和时溶质水平分数最大且不变,然后冷却至30℃并维持温度不变,这一过程硝酸钾溶解度不断变小,浓度不断变小,达到30℃时,溶质水平分数不再改变。
故选:C。
2、填空题(22分)
21.【解答】解:(1)生理盐水是氯化钠的水溶液,溶质是氯化钠;故填:NaCl;
(2)从饱和硫酸铜溶液中析出的蓝色晶体是蓝矾;故填:CuSO4•5H2O;
(3)硝酸银溶液中的溶质是硝酸银;故填:AgNO3;
(4)盐酸是氯化氢气体的水溶液,其中的溶质是氯化氢;故填:HCl。
22.【解答】解:一种或几种物质分散到另一种物质中,形成均一的、稳定的混合物叫做溶液,它的基本特点是均一性和稳定性;只有被分散的物质在另一种物质中是可溶的,二者混合后才会形成溶液;固体小颗粒悬浮在液体里形成的混合物叫悬浊液,基本特点是不均1、不稳定;小液滴分散到液体里形成的混合物叫乳浊液,其基本特点是不均1、不稳定.
依据生活经验,将生石灰投入盛有水的烧杯中,充分搅拌,符合悬浊液的概念和特点,是悬浊液;将该液体静置一会儿,取上层清液,该清液是溶液.组成该清液的物质为氢氧化钙和水,其中前者属溶质,后者属溶剂.
故答案为:悬浊液; 溶液. 氢氧化钙和水,溶质,溶剂.
23.【解答】解:(1)氧化钙能与水反应生成氢氧化钙,会放热,所以溶液的温度将升高;故填:升高;CaO+H2O=Ca(OH)2;
(2)依据氧化钙能与水反应生成氢氧化钙,会使溶液中溶剂降低,同时会使溶液的温度升高,而氢氧化钙的溶解度随温度的升高而减小,所以反应后溶液的水平跟原石灰水相比将会减小;故填:减小;
(3)反应后溶液温度恢复至20℃,跟原石灰水相比,还是20℃的饱和石灰水,所以溶质水平分数不变。故填:不变。
24.【解答】解:(1)配制 200 克 10%的氢氧化钠溶液,第一计算配制溶液所需氢氧化钠和水的水平,再称量所需的氢氧化钠和量取水,最后进行溶解;由于氢氧化钠有腐蚀性,称量时需要放在玻璃器皿中。
(2)溶质水平=溶液水平×溶质的水平分数,配制 200 克 10%的氢氧化钠溶液,需氢氧化钠的水平=200g×10%=20g;溶剂水平=溶液水平﹣溶质水平,则所需水的水平=200g﹣20g=180g(合180mL)。
(3)设需要 20%的氢氧化钠溶液的水平为x,依据溶液稀释前后溶质的水平不变,
则200g×10%=x×20% x=100g。
需要水的水平为200g﹣100g=100g(合100mL)。
故答案为:
(1)计算;称量;溶解;玻璃器皿;
(2)20;180;
(3)100;100。
3、简答卷(18分)
25.【解答】解:蒸发后溶液的水平为200g﹣90g﹣20g=90g;因为蒸发后析出了晶体,则溶液是饱和溶液,溶质水平为200g×30%﹣20g=40g,溶剂水平为200g×(1﹣30%)﹣90g=50g,依据公式![]() ,溶解度为
,溶解度为![]() =80g.
=80g.
故答案为:90;80.
26.【解答】解:(1)通过剖析溶解度曲线可知,P点表示的意思是:t2℃时,A、B物质的溶解度相等;
(2)t3℃时,A、B、C三者溶解度的大小关系为:A>B>C;
(3)将t1℃时B的饱和溶液升温至t3℃,溶解度减小,析出晶体,所以此时溶液的水平减小;
(4)t2℃时,B物质的溶解度是40g,将30克B溶解到60克水中,得到的溶液为饱和溶液,溶质水平分数为![]() ×100%=28.6%;
×100%=28.6%;
(5)C物质的溶解度受温度变化影响较小,所以从C的饱和溶液中获得C晶体的最好办法为蒸发结晶。
故答案为:(1)t2℃时,A、B物质的溶解度相等;
(2)A>B>C;
(3)减小;
(4)饱和溶液,28.6%;
(5)蒸发结晶。
27.【解答】解:①从表中数据可知10℃时,甲的溶解度是35.8g/100g水;
②从表中数据可知乙物质的溶解度受温度影响较大;
③丙物质在20℃时,溶解度为0.165g,是微溶于水;
④30℃时,乙物质饱和溶液的溶质水平分数是![]() ;
;
⑤从表中数据可知50℃时,甲、乙、丙三种物质的溶解度分别为:37g、85g、0.141g与0.121之间,故50℃时,三种物质的溶解度由大到小依次为乙、甲、丙;
⑥乙物质溶解度随温度升高而增大,
a、因为Ⅰ、Ⅱ的溶液均无固体,没办法判断其温度状况,故错误;
b、100g水中分别放入等水平的乙物质,因为Ⅰ、Ⅱ中均无固体,溶液的水平相同,Ⅲ中固体小于Ⅳ,所以溶液的水平Ⅲ>Ⅳ,所以溶液水平:Ⅰ=Ⅱ>Ⅲ>Ⅳ,故正确;
c、因为不了解加入乙物质的水平,没办法判断溶液是不是饱和,故错误;
d、使Ⅳ中的固体全部溶解,假如温度不变,加入适当水,恰好达到饱和时,溶质水平分数不变,故正确;
故答案为:①35.8;②乙;(3)微溶于水;(4)![]() ;(5)乙、甲、丙(6)bd。
;(5)乙、甲、丙(6)bd。
28.【解答】解:(1)t1℃时,A物质的溶解度是10g,所以将15gA加入到150g水中,完全溶解后,恰好得到饱和溶液;为了进一步提升该溶液的溶质水平分数,可进行的操作是:升高温度并加入固体A;
(2)t2℃时,C物质的溶解度最小,小于A、B物质t1℃时的溶解度,所以将t2℃时三种物质的饱和溶液分别降温到t1℃,降温后溶质水平分数最小的是C物质的溶液;
(3)对于溶解度曲线上的点P,
a、A、C物质的溶质相同,所以溶液溶质水平分数相同,故a正确;
b、C的溶液110g中有10g溶质,故b错误;
c、B的溶质小于溶解度,所以溶液处于不饱和状况,故c正确;
d、A、C的溶液水平未必相同,故d错误;
故选:ac;
(4)A物质的溶解度受温度的影响较大,而B物质溶解度受温度影响较小,t1℃时,B物质的溶解度是20g,所以混合物中A的水平大于或等于30g,混合物中A的水平分数w的取值范围是≥![]() ×100%=60%.
×100%=60%.
故答案为:(1)升高温度并加入固体A;
(2)C;
(3)ac;
(4)60%.







