![]() 《初识酸和碱》测试
《初识酸和碱》测试
1、单选题(每小题只有一个正确答案)
1.生活处处有化学。下列日常的有关说法中,正确的是( )
A.中和反应是容易见到的吸热反应 B.“铜绿”是指铜在常温下呈绿色
C.“干冰”就是固体二氧化碳 D.“温室效应”即非常温暖的空间环境
2.蚊虫叮咬时会分泌蚁酸,使叮咬处肿大痛痒。为缓解症状,最好涂抹( )
A.苹果汁 B.牛奶 C.肥皂水 D.炉具清洗剂
3.运输浓硫酸的罐车应贴的安全警示标志是( )
A. B.
B. C.
C. D.
D.
4.两种溶液混合后pH=7,这两种溶液肯定是( )
A.pH>7和pH<7
B.一种是酸,另一种是碳酸钙
C.一种是氯化钠,另一种是硫酸钾
D.没办法确定
5.常温下,下列物质易导电的是()
A.酒精 B.食盐水 C.大理石 D.氯化钾固体
6.某同学在完成用40mL的水稀释浓硫酸的实验操作中,其中不正确的是
A.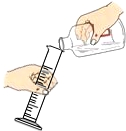 B.
B.![]() C.
C.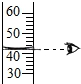 D.
D.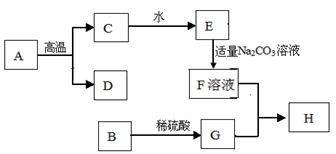
7.下列实验操作符合规范需要的是( )
A.“高锰酸钾制取氧气”实验中,采集好气体后应先将导管移出水槽再停止加热
B.“酸与碱的化学性质”实验中,将实验废液直接倒入下水道
C.“配制50g溶质水平分数15%的氯化钠溶液”实验中,用10mL量筒量取蒸馏水
D.“溶液的酸碱性”实验中,测定溶液pH时应先将试纸湿润
8.下列四个实验策略设计中,适当的是( )
选项 | 实验目的 | 实验策略 |
A | 辨别氧气和二氧化碳 | 将两种气体分别通入滴有紫色石蕊试液的水中 |
B | 稀释浓硫酸 | 将水沿器壁慢慢注入浓硫酸里,并不断搅拌 |
C | 除去氯化钠溶液中的氢氧化钠 | 加入适当的稀硫酸 |
D | 除去氧化钙中的碳酸钙 | 加水充分溶解,过滤 |
A.A B.B C.C D.D
9.下列物质的作用与其物理性质有关的是( )
A.活性炭除去冰箱内的异味 B.氮气可用于制取氮肥
C.用食醋除去水壶中的水垢 D.氧气可用于炼钢
10.几种作物适合成长的PH范围如下:
农作物 | 水稻 | 棉花 | 甘蔗 | 烟草 | 茶树 |
PH范围 | 6.0~7.0 | 6.0~6.8 | 6.0~8.0 | 5.0~6.0 | 5.0~5.5 |
取某土壤浸出液加几滴紫色石蕊试液,溶液略显蓝色.则这种土壤适合种植的农作物是( )
A.水稻 B.棉花 C.甘蔗 D.茶树
11.下列说法正确的是
A.能电离出氢离子的化合物就叫做酸
B.酸碱中都含有氢元素
C.NO3-、SO42-、CO32-等叫做酸根离子,Cl-不是酸根离子
D.化学式中含有氢氧根的化合物是碱
12.对下列现象或事实讲解错误的是( )
A.O2和O3化学性质不同,由于O2和O3分子结构不同
B.用熟石灰改良酸性土填,由于H+和OH-能结合生成H2O
C.水银温度计能指示温度,由于汞原子间的距离随温度升高而增大
D.液态水受热变成水蒸气体积变大,由于水分子的体积受热变大了
13.下面是四个实验有关的图象其中对应表示正确的是()
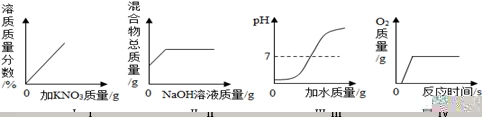
A.I是在肯定温度下,向不饱和的ΚNO3溶液中加ΚNO3固体
B.Ⅱ是向适量的CuSO4溶液中滴加NaOH溶液
C.Ⅲ是将适量的稀H2SO4加水稀释
D.Ⅳ是实验室加热适量的ΚMnO4制取O2
14.下列各组离子,在溶液中能很多共存的是( )
A.Na+、NH4+、NO3﹣、SO42﹣ B.H+、Na+、HCO3﹣、Cl﹣
C.Ba2+、Ag+、Cl﹣、CO32﹣ D.K+、Mg2+、NO3﹣、OH﹣
2、填空题
15.化学就在大家身边,它与大家的生活息息有关.请按需要从下列物质中选择填空(填序号):①石墨②纯碱③熟石灰④酚醛塑料⑤棉花⑥油脂
(1)是天然纤维的是__________
(2)是有机合成材料的是________
(3)具备优良导电性能的是________
(4)可以用来改良酸性土壤的是_________.
16.从Ca、C、S、H、O、N六种元素中选择合适的元素写出符合下列需要的物质的化学式.
(1)最常见的溶剂___________________(2)充入食品包装袋中可防腐的单质_________
(3)常用来改良酸性土壤的碱_________(4)能形成硫酸型酸雨的空气污染物_________
17.甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验。
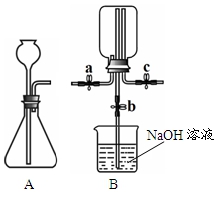
(1)甲组实验:
① 在A装置的锥形瓶中加入大理石,向长颈漏斗中注入稀盐酸,A中反应的化学方程式为_____。
② 连接A、B装置,打开a、c,关闭b,向B中集气瓶内充入气体,检验集气瓶中气体已采集满的办法是_____。
③ 关闭a、c,打开b,用冷毛巾捂住B中集气瓶,一段时间后,察看到B装置中的现象是_____, B中反应的化学方程式为_____。
(2)乙组实验:
(资料)氯化氢气体和氨气均极易溶于水,且两者反应生成白色固体氯化铵(NH4Cl)。
在c右端的导管口套一个气球,在A的锥形瓶中放入浓盐酸,向长颈漏斗中注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体是什么原因_____。
② 关闭a,将A中的药品替换为NaOH固体和浓氨水,待A中的空气被排净后,连接A、B装置,打开a,一段时间后关闭a,B中集气瓶内有白烟产生。冷却至室温后气球恢复原状。关闭c打开b,B中导管内的液面无任何变化。产生上述现象是什么原因_____。
18.化学常识在生产,日常有广泛的应用。
(1)日常常用______办法减少水的硬度。
(2)日常,切菜刀使用的防锈手段是_______。
(3)用下列物质除去油污时,借助乳化用途的是______(选填序号)。
A汽油 B洗洁精 C氢氧化钠溶液
(4)小苏打可用作治疗胃酸过多的药剂,用化学方程式表示其治疗原理_______。
(5)打开汽水瓶盖,有气泡冒出,说明气体溶解度随压强减小而______。
19.下列物质露置在空气中一段时间后,水平会增加的是(____)
A.浓硫酸 B.浓盐酸 C.石灰石 D.____________
3、判断题
20.构建常识互联网可以帮助大家理解常识间的内在联系,下图是盐酸与不相同种类别物质之间反应的常识互联网图,请回答下列有关问题
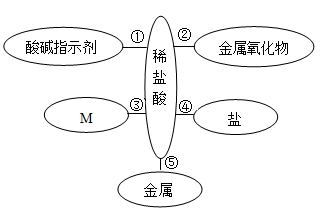
(1)过程①的现象为:紫色石蕊试液变为_____色,稀盐酸的值_____7(填“>”“=”“<”之一)。
(2)工业上常用过程②除去铁锈(主要成分是Fe2O3),现象为:铁锈渐渐溶解,溶液出无色渐渐变为_____色,此反应是_____反应。
(3)盐酸能与M类物质反应的实质是盐酸中的H+与M中的_____(写离子符号)反应生成水,试写出符合条件的一个化学反应的方程的式_____。
(4)若过程④产生不溶于稀硝酸的白色沉淀,试写出符合条件的一个化学反应的方程式_____。
(5)若过程⑤中金属为镁,则产生的气体为_____。(填写化学式)
21.框图中的物质均为中学化学容易见到物质,其中A是大理石的主要成分,B是黑色粉末,H是蓝色沉淀。下图是它们之间的转化关系,请回答。

(1)写出下列物质的化学式:B__________;C__________;
(2)写出 F + G→ H的化学方程式:__________;
(3)写出B→G 的化学方程式:__________。
4、实验题
22.(1)如图是实验室制取气体的一些装置,据图回答:
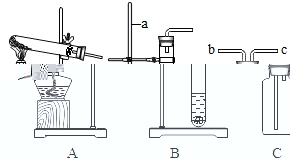
①如图仪器a的名字是_____。
②用高锰酸钾制取氧气的化学方程式是_____。若用C装置采集氧气,验满时,应将带火星的木条放在_____(填“b”或“c”)端导管口,若木条复燃,说明氧气已满。
(2)某校化学兴趣小组在学完碱的化学性质后,做了澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进行了如下探究:
探究Ⅰ:甲同学在做实验时没察看到明显现象,于是对澄清石灰水和稀盐酸能否发生反应表示怀疑,乙同学觉得,甲同学实验时应先向澄淸石灰水中滴几滴酚酞试液,再滴加适当的稀盐酸,当察看到_____时,就能说明两种物质能发生反应。
探究Ⅱ:废液中溶质的成分是什么?
(做出猜想)
猜想1、CaCl2
猜想2、CaCl2、HCl
猜想3、CaCl2、HCl、Ca(OH)2
你的猜想:_____
丙同学觉得猜想三是不对的,理由是_____(用化学方程式讲解)。
(实验设计)
设计者 | 实验操作 | 实验现象 | 实验结论 |
丁同学 | 取少量废液于一支试管中,向其中加入足量的碳酸钠溶液 | 有白色沉淀生成 | 猜想一正确 |
戊同学 | 取几粒锌粒于一支试管中,向其中加入少量废液 | _____ | 猜想二正确 |
(评价与深思)请判断以上设计的两个策略中,_____同学的策略合理,请剖析另一个策略不适当的理由:_____。
(表达与交流)若实验证明猜想二是正确的,你觉得该废液来经处置直接倒入下水道,可能导致的害处是_____(填一点)。
23.依据下列实验装置图,回答下列有关问题。
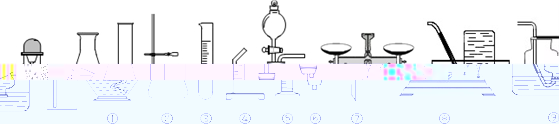
(1)标号②的仪器名字:_________。
(2)用氯酸钾制取氧气,发生装置可选择上图中的_______(填标号)进行组装,该反应的化学方程式是_____________________;该反应的基本种类是___________________。
(3)实验室可将②⑦⑩连接制取并采集二氧化碳,反应的化学方程式为_____________;检验二氧化碳气体的化学方程式___________________;若要采集干燥的二氧化碳,还应增加一个装有_________________的洗气瓶。
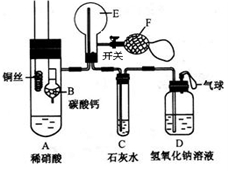
(4)已知:一氧化氮(NO)是一种无色气体,极易与氧气反应生成红棕色二氧化氮气体(NO2)。为了证明铜与稀硝酸反应生成一氧化氮气体,某兴趣小组同学设计实验,其装置如图所示(加热装置和固定装置均已略去):B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。(铜丝和金属丝都可以上下移动)

兴趣小组同学在确定装置气密性好并装入药品后,进行了以下操作:先将装CaCO3的干燥管下移使CaCO3与稀HNO3反应产生CO2,察看到装置C中石灰水变浑浊后,将铜丝下移使之与稀HNO3起反应。
①先让CaCO3与稀HNO3反应产生CO2的目的是______________________;
②铜丝和金属丝设计成可以上下移动的优点是________________________;
③写出一氧化氮与氧气反应生成二氧化氮气体的化学方程式_________________;
④证明E中采集到的气体是NO的办法是_________________;
⑤下列关于一氧化氮和二氧化氮的说法正确的是_________________________。
A.两者都是非金属氧化物
B.一氧化氮可发生氧化反应
C.二氧化氮可能被氢氧化钠溶液吸收
5、计算题
24.钠的化合物在日常有着广泛的应用.
(1)依据生活经验推断,汗水中产生咸味的物质可能由__________(填“原子”、“分子”、“离子”)构成的;
(2)碳酸氢钠是发酵粉的有效成分,碳酸氢钠与稀盐酸反应的化学方程式为__________;
(3)盛放氢氧化钠的试剂瓶若密封不严会使氢氧化钠发生变质.氢氧化钠变质是什么原因(用化学方程式表示)__________;
(4)某无色溶液可能由氢氧化钠溶液、氯化钠溶液、碳酸钠溶液中的一种或几种混合而成.为探究其组成.小华同学进行了如下实验:取适当样品放入试管中,滴加酚酞溶液,溶液变成红色.再向试管中逐滴加入过量氯化钙溶液,察看到有沉淀产生,过滤后滤液仍为红色,由实验现象可判断出样品中肯定含有些物质是__________(写化学式),可能含有些物质是__________(写化学式);
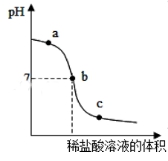
(5)向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时溶液中的溶质是__________.
(6)食用纯碱中常含有少量的氯化钠.现取某食用纯碱样品10g,加入适量稀盐酸溶液恰好完全反应,同时产生了3.3g气体,试计算该食用纯碱中Na2CO3的水平分数(写出计算过程).
25.某同学为探究生石灰暴露空气中的变质状况,设计如下实验:称取生石灰w,露置空气一段时间后,所得粉末A的水平为1.2w,加入足量稀盐酸,生成气体B,依次通入浓硫酸,足量澄清石灰水,得到沉淀0.25w。判断粉末A的组成________(写了解成分及其对应水平),计算粉末A 中氧化钙的水平分数________。
参考答案
1.C 2.C 3.A 4.C 5.B 6.C 7.A 8.A 9.A 10.C 11.B 12.D 13.D 14.A
15.⑤ ④ ① ③
16.H2O N2 Ca(OH)2 SO2
17.(1) ① CaCO3+ 2HCl = CaCl2+ H2O+ CO2↑
②将燃着的木条放在c右端的导管口处,若熄灭则气体已集满。
③烧杯中的无色液体沿导管进入到集气瓶中(或形成喷泉)
2NaOH + CO2 = Na2CO3+ H2O
(2)① 浓硫酸溶于水会放出很多热,使浓盐酸中的HCl气体溶解度减小,致使HCl
气体逸出。
② NH3和HCl恰好完全反应,集气瓶内的充气压力与外面大方压相等。(2分)
18.煮沸 维持刀表面清洗和干燥(或将刀表面洗净、擦干)(写涂油不给分) B NaHCO3+HCl=NaCl+H2O+CO2![]() 减小
减小
19. A 烧碱固体(生石灰等)
20.红 < 黄色 复分解 OH- HCl+NaOH=NaCl+H2O AgNO3+HCl=HNO3+AgCl↓ H2
21.(1)CuO; CaO;
(2)H2SO4+CuO=CuSO4+H2O;
(3)CuSO4+2NaOH=Cu2↓+2Na2SO4 。
22.铁架台 2KMnO4![]() K2MnO4+MnO2+O2↑ c 溶液的红色褪去 CaCl2、Ca(OH)2 2HCl+Ca(OH)2=CaCl2+2H2O 锌粒渐渐溶解,有气泡产生 戊 猜想中都有氯化钙,加碳酸钠溶液都会产生白色沉淀 腐蚀下水道或污染水质。
K2MnO4+MnO2+O2↑ c 溶液的红色褪去 CaCl2、Ca(OH)2 2HCl+Ca(OH)2=CaCl2+2H2O 锌粒渐渐溶解,有气泡产生 戊 猜想中都有氯化钙,加碳酸钠溶液都会产生白色沉淀 腐蚀下水道或污染水质。
23. 锥形瓶 ①③④⑥ 2KClO3![]() 2KCl+3O2↑ 分解反应 CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca2=CaCO3↓+H2O 浓硫酸 排干净空气 可控制反应的发生与停止 2NO+O2=2NO2 打开开关,鼓入空气,由无色变红棕色,证明是NO ABC
2KCl+3O2↑ 分解反应 CaCO3+2HCl=CaCl2+CO2↑+H2O CO2+Ca2=CaCO3↓+H2O 浓硫酸 排干净空气 可控制反应的发生与停止 2NO+O2=2NO2 打开开关,鼓入空气,由无色变红棕色,证明是NO ABC
24.(1)离子;(2)NaHCO3+HCl=NaCl+H2O+CO2↑;
(3)2NaOH+CO2═Na2CO3 +H2O(4)NaOH和Na2CO3;NaCl
(5)氢氧化钠和氯化钠(6)79.5%.
25.CaO 0.58w 、Ca(OH)2,0.37w、 CaCO3,0.25w 48.3%







